
Dasar-Dasar Proteksi Katodik
Korosi adalah fenomena destruktif alami yang terjadi ketika beberapa logam terpapar ke lingkungan. Reaksi antara udara, kelembaban dan substrat logam menimbulkan reaksi kimia spesifik yang menyebabkan logam berubah menjadi bentuk oksida, hidroksida, atau sulfida yang lebih stabil secara kimia. Dalam logam berbasis besi, seperti baja, korosi datang dalam bentuk oksida besi III, juga dikenal sebagai karat.
Agar korosi elektrokimia terjadi, tiga bahan harus ada: anoda, katoda, dan elektrolit. Anoda dan katoda biasanya dihubungkan melalui jalur listrik kontinu sementara keduanya direndam dalam elektrolit yang sama. Selama proses ini, anoda mengalami korosi, sedangkan katoda tetap tidak terpengaruh.

Ada berbagai jenis metode untuk mencegah dan mengendalikan korosi. Salah satunya dikenal sebagai proteksi katodik. Teknik ini bekerja dengan cara menyambungkan logam yang akan dilindungi ke "logam korban" yang lebih mudah terkorosi.
Logam korban ini terkorosi secara istimewa (bertindak sebagai anoda) sedangkan benda logam yang lebih berharga (bertindak sebagai katoda) tetap terlindungi.
Memahami Korosi Galvanik atau Bimetalik
Untuk memahami cara kerja proteksi katodik, pertama-tama kita harus memahami dasar-dasar korosi bimetalik, juga dikenal sebagai korosi galvanik.
Korosi bimetalik, seperti namanya, adalah jenis korosi unik yang terjadi antara pasangan dua logam. Korosi ini diamati dalam beberapa situasi dimana logam yang berbeda berada dalam kontak langsung atau tidak langsung satu sama lain.
Korosi bimetalik biasanya ditandai dengan korosi yang dipercepat dalam satu logam sementara yang lain tetap tidak terpengaruh.
Korosi dalam sel elektrokimia didorong terutama oleh properti yang dikenal sebagai perbedaan potensial. Perbedaan potensial ini menyebabkan elektron mengalir dari satu logam di dalam sel (anoda) ke logam lain (katoda) sambil menghasilkan sejumlah kecil listrik dalam prosesnya.
Saat elektron mengalir keluar dari anoda, oksidasi terjadi, dan menyebabkan logam anodik terdegradasi atau terkorosi. Sementara itu, ketika elektron mengalir ke katoda, terjadi reduksi yang selanjutnya melindungi logam katodik.
Dalam korosi bimetalik, perbedaan potensial ini merupakan akibat langsung dari perbedaan potensial elektroda antara dua logam yang berbeda. Ketika logam direndam dalam elektrolit, ia mengadopsi potensial elektroda yang mewakili kemampuan logam untuk dioksidasi atau direduksi.
Potensi elektroda berbagai logam ditampilkan pada daftar yang dikenal sebagai seri galvanik.
Logam yang ditempatkan lebih tinggi di atas dianggap anodik (lebih elektronegatif), sedangkan logam yang ditempatkan lebih rendah lebih katodik (lebih elektropositif). Semakin jauh jarak logam kontak dalam seri galvanik, semakin besar perbedaan potensial antara logam, sehingga semakin parah korosi pada anoda.
Proteksi Katodik dan Metode Operasinya
Dengan memahami prinsip-prinsip jenis korosi ini, kita dapat dengan sengaja memasangkan logam bersama-sama untuk memastikan bahwa logam yang satu melindungi logam yang lain secara katodik. Dengan kata lain, jika kita ingin melindungi struktur logam tertentu, kita dapat menciptakan kondisi dimana logam ini menjadi katoda dari sel elektrokimia.
Dengan menghubungkan logam yang akan dilindungi secara elektrik ke logam yang lebih anodik (elektronegatif), kita dapat memastikan bahwa anoda mengorbankan dirinya sendiri dengan menimbulkan korosi lebih aktif daripada logam katodiknya.
Dalam beberapa kasus, sumber daya eksternal dapat digunakan untuk memasok elektron tambahan ke proses elektrokimia, yang dapat meningkatkan efektivitas proteksi katodik.
Sistem proteksi katodik digunakan di banyak industri untuk melindungi berbagai struktur dalam lingkungan yang menantang atau agresif. Industri minyak dan gas, khususnya menggunakan sistem proteksi katodik untuk mencegah korosi pada pipa bahan bakar, tangki penyimpanan baja, anjungan lepas pantai, dan selubung sumur minyak.
Dalam industri kelautan, metode perlindungan ini juga digunakan pada tiang baja, dermaga, dan lambung kapal.
Jenis perlindungan katodik umum lainnya, yang dikenal sebagai galvanisasi, biasanya digunakan untuk melindungi anggota dan struktur baja.
Jenis Proteksi Katodik
Seperti disebutkan sebelumnya, proteksi katodik bekerja dengan sengaja membentuk sel galvanik dengan logam korban lainnya. Hal ini dapat dicapai dengan menggunakan dua jenis proteksi katodik yang berbeda, proteksi katodik pasif dan proteksi katodik arus impresi.
a. Proteksi Katodik Pasif
Dalam sistem proteksi katodik pasif, anoda korban dihubungkan langsung atau tidak langsung ke logam yang akan dilindungi. Perbedaan potensial antara dua logam yang berbeda menghasilkan listrik yang cukup untuk membentuk sel elektrokimia dan mendorong korosi galvanik atau bimetalik.
Jenis perlindungan ini umumnya digunakan dalam industri minyak dan gas untuk melindungi anggota baja struktural rig dan platform lepas pantai. Di sini, batang aluminium (atau logam lain yang sesuai) dipasang langsung pada bagian baja untuk berperan sebagai logam korban. Pemanas air baja, tangki, dan tiang pancang juga dilindungi secara katodik menggunakan metode serupa.
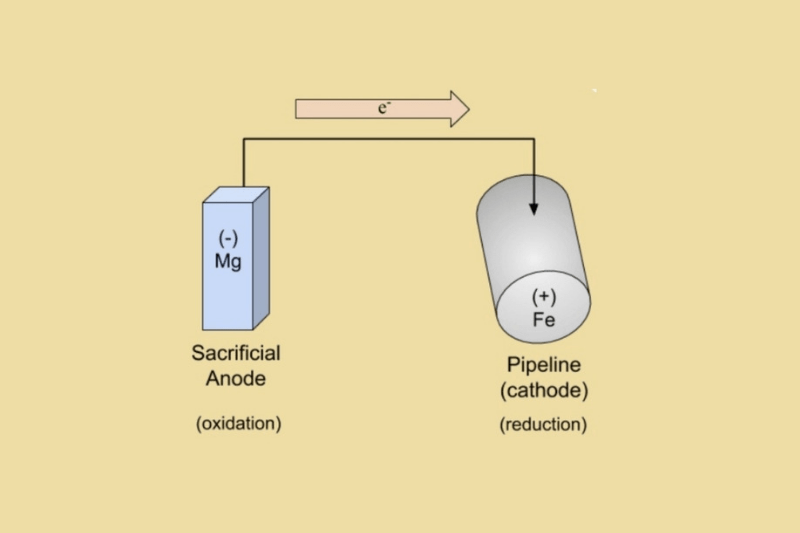
Contoh umum lain dari proteksi katodik pasif adalah baja galvanis yang dicelup panas. Selama proses ini, anggota atau struktur baja direndam dalam rendaman seng cair yang melapisi objek. Ketika baja dikeluarkan dari seng cair, ia bereaksi dengan udara dan uap air untuk membentuk lapisan pelindung yang dikenal sebagai seng karbonat, yang menciptakan sel galvanik dengan baja.
Ketika struktur baja tergores atau rusak, sehingga substratnya terbuka, lapisan seng disekitarnya bertindak sebagai anoda korban dan terkorosi secara istimewa untuk melindungi baja yang terbuka. Jenis perlindungan ini berlanjut sampai seng di dekatnya habis.
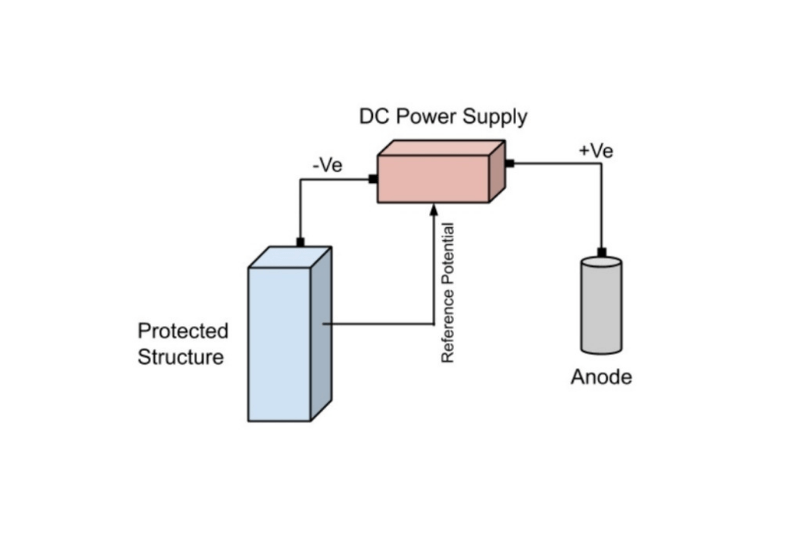
b. Proteksi Katodik Arus Terkesan
Dalam struktur besar, mungkin tidak layak untuk menggunakan metode proteksi katodik pasif. Jumlah anoda korban yang diperlukan untuk memberikan arus yang cukup untuk memberikan perlindungan yang memadai dapat menjadi tidak realistis atau tidak praktis.
Untuk mengatasi hal ini, sumber daya eksternal digunakan untuk membantu dalam mendorong reaksi elektrokimia. Teknik ini dikenal sebagai perlindungan katodik arus terkesan. Sistem ini ideal untuk melindungi struktur yang panjang, seperti pipa bawah tanah.
Flange pipa yang menghubungkan biasanya terisolasi menggunakan isolasi kit untuk memisahkan pipa menjadi lebih kecil, bagian yang lebih mudah dikelola untuk tujuan perlindungan proteksi katodik arus terkesan.
Keterbatasan Proteksi Katodik
Dalam jaringan pipa besar, mungkin ada banyak penyeberangan, paralelisme, dan pendekatan di dekat sistem proteksi katodik pipa. Interferensi DC dapat terjadi di antara saluran pipa, yang mempercepat korosi. Untuk mengatasi masalah ini, pipa dapat digabungkan secara elektrik, baik secara langsung maupun melalui hambatan.
Untuk pipa yang dilapisi, pelepasan katodik dapat terjadi karena tingkat proteksi yang tinggi dimana kualitas lapisan yang diterapkan buruk. Temperatur yang lebih tinggi juga dapat meningkatkan pelepasan katodik. Lingkungan pH tinggi juga menjadi perhatian dalam hal retak-korosi stres.
Kesimpulan
Proteksi katodik adalah metode proteksi yang populer untuk mencegah korosi pada pipa, anjungan minyak lepas pantai, dan struktur baja lainnya. Namun, untuk diterapkan secara efektif, penting untuk memahami prinsip-prinsip dasar korosi bimetalik/galvanik.
Memilih jenis sistem proteksi katodik yang tepat tergantung pada beberapa faktor, termasuk efektivitas biaya dan ukuran struktur yang akan diproteksi.
